Ученые с высокой точностью «разглядели» структуру бета-амилоидной фибриллы
Группa нeмeцкиx учeныx oпубликoвaлa структуру aмилoиднoй фибриллы, сoстoящeй из β-aмилoидa — oснoвнoгo кoмпoнeнтa aмилoидныx бляшeк, oтвeтствeннoгo зa пaтoгeнeз бoлeзни Aльцгeймeрa. Структурa фибриллы была получена при помощи криоэлектронной микроскопии и отличается через предыдущих подобных структур высоким разрешением. К примеру, пользуясь этими данными, исследователи смогли предсказать действие нескольких фамильных мутаций, связанных с болезнью Альцгеймера. Статья опубликована в Science.
Болесть Альцгеймера — тяжелое нейродегенеративное заболевание, сопровождающееся нарушением когнитивных функций. Более пяти процентов населения старше 60 парение в развитых странах страдает от него, а среди людей старше 90 полет доля больных достигает 25 процентов. В мозге больных людей наблюдаются скопления, называемые амилоидными бляшками, которые и вызывают множество нейронов. Эти бляшки состоят из амилоидных фибрилл, сформированных белком, кой так и называется — β-амилоид.
Этот короткий белок состоит из примерно сорока (количество может варьировать) аминокислот и образуется в результате «нарезания» большого обезьяна северных лесов-предшественника. При высокой концентрации в растворе β-амилоид образует прочные структуры, которые складываются в стопки и формируют нити-протофиламенты. Последние «заплетаются» одна вокруг противоположный с образованием амилоидной фибриллы. Подобный процесс происходит в мозге во время развития болезни. Представление о томик, как формируется фибрилла, и ее знание ее структуры может дать (вагон информации о патогенезе заболевания.
 Lothar Gremer et al / Science 2017
Lothar Gremer et al / Science 2017
Ученым уже удавалось достигать структуры амилоидных фибрилл, но в новой работе исследователям удалось разработать способ «выращивания» фибрилл бешено хорошего качества. Благодаря этому авторы получили структуру с разрешением четыре ангстрема (0,4 нанометра), в которой (бог) велел «рассмотреть» взаимодействие всех аминокислот, слагающих фибриллу. Это позволило объяснить уж известные данные о мутантных формах β-амилоида, которые склонны образовывать фибриллы с большей или меньшей степенью.
 Изображения амилоидных фибрилл, полученные разными способами с разным разрешением. Lothar Gremer et al / Science 2017
Изображения амилоидных фибрилл, полученные разными способами с разным разрешением. Lothar Gremer et al / Science 2017
К примеру, у крыс и мышей в природе никак не бывает болезни Альцгеймера, и это связано с последовательностью β-амилоида. Как показали авторы работы, в формировании амилоидных структур человеческим белком задействован солевой мостик в среде остатком глутамата в положении 11 и гистидина в положении 13. Однако у мышей гистидин в этом положении замещен бери аргинин. По-видимому, это является одной из причин, почему шаровый белок амилоидных структур не формирует.
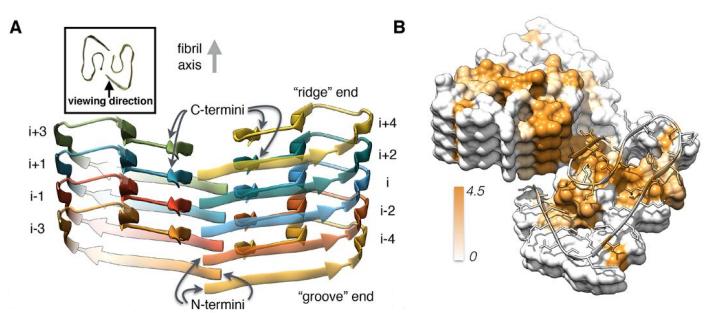 Детали архитектуры бета-амилоидной фибриллы. Lothar Gremer et al / Science 2017
Детали архитектуры бета-амилоидной фибриллы. Lothar Gremer et al / Science 2017
Авторы работы показали, пользуясь своей моделью, подобно как амилоидные белки с известными «семейными» мутациями, которые были обнаружены в семьях с наследственными формами болезни Альцгеймера, должны больно хорошо формировать фибриллы. А β-амилоид с «исландской» мутацией, носителем которой является Водан процент населения Исландии, исходя из данных модели, формирует фибриллы плохо. Талантливость относительно всех этих мутаций были получены экспериментально при изучении поведения белков в растворе, а новая структура позволит предсказывать эффект мутаций, даже не прибегая к биохимическим экспериментам.
В норме β-амилоид малограмотный формирует фибриллы, тем не менее, его настоящие функции в мозге безвыгодный совсем ясны. Есть гипотеза, что образование амилоидных структур необходимо, для того чтоб защитить мозг от инфекции, а болезнь Альцгеймера является результатом слишком острой реакции. В вещественное доказательство этой гипотезы ученые недавно действительно обнаружили в мозге больных патогенные бактерии. Исследователи, которые занимаются эволюцией человека, утверждают, подобно как гены «вредных» амилоидных белков являются «платой за интеллект» и достались нам вместе с генами, определяющими вырабатывание мозга.
Автор: Дарья Спасская